اقتباس:
المشاركة الأصلية كتبت بواسطة الكنز الذهبي
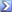
1 ـ تحلّيل وتفسّير المنحنى عند قيمة الـ 7.5 = pH
يمثل المنحنى تغيرات سرعة الانزيم بدلالة زيادة تركيز مادة التفاعل ، حيث نسجل مرحلتين :
م 1* من تركيز 2 - 6 : نلاحظ زيادة سرعة الانزيم بزيادة تركيز الركيزة لتبلغ V20 عند التركيز6
م 2* من تركيز 6 - 7 : نلاحظ ثبات سرعة الانزيم عند القيمة V20رغم الزيادة في تركيز الركيزة
و نفسر ذلك بأن المواقع الفعالة لكمية الانزيم لم تكن كلها محجوزة من قبل مادة التفاعل في بداية التجربة و بزيادة كمية الركيزة يزيد عدد الانزيمات النشطة و بالتالي السرعة و لكن في التراكيز العالية تكون المواقع الفعالة للانزيمات كلها محجوزة مما يفسر ثبات السرعة
2 ـ
أ – تحدّد نسبة (ES) [الإنزيم المرتبط بركيزته] عند قيمة الـ7.5 = pH و تركيز مادّة التفاعل 50 وحدة إعتباريّة.
أي V = 18
20---------------------------------------------100%
18----------------------------------------------x %
%x = 18*100 % / 20 = 90
ب- حساب نسبة الإنزيم المرتبط بركيزته (ES) عند قيمة الـ 7.5 = pH و V = 18.33 .
20---------------------------------------------100%
18.33----------------------------------------------x %
x = 18.33*100 % / 20 = 91.65%
جـ - استنتج نسبة الإنزيم الحر عند قيمة الـ 7.5 = pH و V = 18.33 .
100%-91.65% = 8.35%
3- مثّل بمعادلة بيوكميائيّة تحلّل ثنائي الببتيد Alanyltyrosine إلى Ala وTyr بفعل إنزيم Carboxypeptidase .
NH2-C--CH3-H-CO-NH-C--CH2--H-COOH + H2O =========== NH2-C--CH3-H-COOH + NH2-C--CH2--H-COOH
إنزيم Carboxypeptidase
4- فسّر تغيّر سرعة الإنزيم المدروس بتغيّر pH الوسط .
تعتبر PH=7.5 هي ال PHiالمثلى لهذا الانزيم Carboxypeptidase حيث يكون نشاطه أعظمي عندها
و بانخفاظ فيمة PH الوسط تنخفض سرعة الانزيم و نفسر ذلك بتأثير ال PH على شحنة المجموعات الكيميائية الحرة في الجذور الاحماض الامينية و خاصة تلك الموجودة في الموقع الفعال للانزيم مما يمنع حدوث التكامل بين الموقع الفعال و الركيزة .
|
ا
جابة مناسبة فقط ننوه باخطاء في رسم المنحنى الدى قيمه الحقيقية هى

كدلك السؤال الاخير اظهار حالة الانزيم في الوسط القاعدى و الحامضى