

|
|
|||||||
| المواد العلمية و التقنية كل ما يخص المواد العلمية و التقنية: الرياضيات - العلوم الطبيعة والحياة - العلوم الفيزيائية - الهندسة المدنية - هندسة الطرائق - الهندسة الميكانيكية - الهندسة الكهربائية - إعلام آلي. |
في حال وجود أي مواضيع أو ردود
مُخالفة من قبل الأعضاء، يُرجى الإبلاغ عنها فورًا باستخدام أيقونة
![]() ( تقرير عن مشاركة سيئة )، و الموجودة أسفل كل مشاركة .
( تقرير عن مشاركة سيئة )، و الموجودة أسفل كل مشاركة .
| آخر المواضيع |
|
♥ ~ سلام .. ممكن احد يدخل يفهمني كيمياء ♥ ~
 |
|
|
أدوات الموضوع | انواع عرض الموضوع |
|
|
رقم المشاركة : 31 | ||||
|
خامساً : تمثيل لويس لمركبات تحوي عدداً فردياً من الإلكترونات تركيب لويس للجزيء هو : في هذه الصيغة انطبقت قاعدة الثمانية على الأكسجين ولم تنطبق على النيتروجين حيث عدد الإلكترونات ( 7 ) أي يوجد الكترون منفرد، حتى قاعدة الثنائي لا تنطبق على النيتروجين لوجود هذا الإلكترون المنفرد. 2- فوق أكسيد النيتروجين: وصيغته المختصرة NO2 عدد الكترونات التكافؤ للنيتروجين ( 5 ) . عدد الكترونات التكافؤ للأكسجين ( 6 ) ، يوجد منه ذرتان إذن مجموع الكترونات الأكسجين ( 12 ) . إذن مجموع الكترونات التكافؤ للجزيء = ( 5 + 12 = 17 ) . تركيب لويس للجزيء هو : انطبقت قاعدة الثمانية على الأكسجين .  لا قاعدة الثمانية ولا قاعدة الثنائي تنطبق على النيتروجين لوجود الإلكترون المنفرد . يوجد عدد محدود من المركبات المستقرة ذات الأعداد الفردية من الإلكترونات ويمكن اعتبارها من الشواذ ومتوافقة مع المقولة المشهورة "لكل قاعدة شواذ" .
|
||||

|
|
|
رقم المشاركة : 32 | |||
|
سادساً : تمثيل لويس للمجموعات الكيميائية  ، 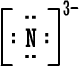 ، 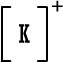 ، 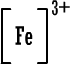 نسمي هذا النوع من الأيونات باسم الأيونات البسيطة إذن الأيون البسيط : هو ذرة واحدة أصبحت مشحونة نتيجة كسبها أو فقدانها لإلكترون واحد أو عدة الكترونات . يوجد مقابل هذا النوع البسيط من الأيونات أيونات تتكون من عدة ذرات Polyatomic Ionsيمكن أن نطلق عليها اسم الأيونات المركبة أو الأيونات عديدة الذرات ، وهذه الأيونات تتصرف كوحدة واحدة ولا تتجزأ عند دخولها في تفاعلات كيميائية وتكوين روابط ، أي أنها تسلك سلوك الأيونات البسيطة . وأنت ربما تذكر وتعرف بعضاً منها مثل : أيون الهيدرونيوم+[ H3O ]، أيون الأمونيوم +[ NH4 ]، أيون الهيدروكسيد (الذي يكوّن الشق السالب في القواعد) -[ OH ]. وأيون الكربونات [ CO3 ]2- الذي هوالشق السالب لمركب كربونات الكالسيوم الموجود في الطبيعة بعديد الأشكال منها الحجر الجيري بأشكاله والطباشير والرخام . نُسمي هذه الأيونات عديدة الذرات باسم المجموعات الكيماوية وهذه أيونات مركبة بالمقارنة مع الأيونات البسيطة التي تتكون من ذرة واحدة . وهذه الأيونات تتصرف كوحدة واحدة ولا تتجزأ عند دخولها في تفاعلات كيميائية مع غيرها وتكوين روابط ، أي أنها تسلك سلوك الأيونات البسيطة . أمثلة على صيغ لويس للأيونات عديدة الذرات ( المجموعات الكيماوية ) . اضغط على المثال لرؤية الحل  مثال (1) :أيون الهيدرونيوم وصيغته +[ H3O ]. مثال (1) :أيون الهيدرونيوم وصيغته +[ H3O ]. مثال (2) :أيون أو مجموعة الأمونيوم +[ NH4 ] . مثال (2) :أيون أو مجموعة الأمونيوم +[ NH4 ] . مثال (3) :مجموعة الهيدروكسيد ـ[ OH ] هذه المجموعة تعطي القواعد خواصها وتسيطر في المحاليل المائية للقواعد وتعادل أيون الهيدرونيوم الحامض . مثال (3) :مجموعة الهيدروكسيد ـ[ OH ] هذه المجموعة تعطي القواعد خواصها وتسيطر في المحاليل المائية للقواعد وتعادل أيون الهيدرونيوم الحامض . |
|||

|
|
|
رقم المشاركة : 33 | |||
|
الخلاصة : 1. الكترونات التكافؤ (أو الكترونات الربط) :هي الالكترونات التي تحتل المستوى الإلكتروني الخارجي للذرة . 2. إذا كان المستوى الإلكتروني الخارجي غير مكتمل ( غير ممتليء تماماً بالإلكترونات ) فتكون العناصر قادرة على القيام بتفاعلات كيميائية وتكوين روابط ومركبات كيميائية مع غيرها ، وبالطبع يختلف نشاطها من عنصر لآخر . 3. إذا كان المستوى الإلكتروني الخارجي مكتملاً ( ممتلئ تماماً بالإلكترونات ) يكون نشاط العناصر ضعيفاً جداً ( إلى حد يكاد يكون معدوماً ) فلا تكون روابط ومركبات مع غيرها إلا بصعوبة وهذا هو حال المجموعة الثامنة أو مجموعة الغازات النبيلة في الجدول الدوري . 4. يوجد في المستوى الخارجي الأبعد عن النواة في ذرة كل غاز نبيل ثمانية الكترونات ( ما عدا الهيليوم الذي يمتلك الكترونين فقط وهو مستقر بهما ) وهذه الغازات هي نموذج الاستقرار . 5. قاعدة الثمانية : تميل الذرات لفقدان أو كسب الإلكترونات أو المشاركة بها بحيث تصبح محاطة بثمانية من الكترونات التكافؤ ( تصبح مشابهة للتركيب الإلكتروني للغازات النبيلة ) . 6. الإلكترونات الثمانية تعتبر أربعة أزواج من الكترونات التكافؤ وترتب حول رمز العنصر عند كتابة رموز وتراكيب لويس . |
|||

|
|
|
رقم المشاركة : 34 | |||
|
الخلاصة : 1. الكترونات التكافؤ (أو الكترونات الربط) :هي الالكترونات التي تحتل المستوى الإلكتروني الخارجي للذرة . 2. إذا كان المستوى الإلكتروني الخارجي غير مكتمل ( غير ممتليء تماماً بالإلكترونات ) فتكون العناصر قادرة على القيام بتفاعلات كيميائية وتكوين روابط ومركبات كيميائية مع غيرها ، وبالطبع يختلف نشاطها من عنصر لآخر . 3. إذا كان المستوى الإلكتروني الخارجي مكتملاً ( ممتلئ تماماً بالإلكترونات ) يكون نشاط العناصر ضعيفاً جداً ( إلى حد يكاد يكون معدوماً ) فلا تكون روابط ومركبات مع غيرها إلا بصعوبة وهذا هو حال المجموعة الثامنة أو مجموعة الغازات النبيلة في الجدول الدوري . 4. يوجد في المستوى الخارجي الأبعد عن النواة في ذرة كل غاز نبيل ثمانية الكترونات ( ما عدا الهيليوم الذي يمتلك الكترونين فقط وهو مستقر بهما ) وهذه الغازات هي نموذج الاستقرار . 5. قاعدة الثمانية : تميل الذرات لفقدان أو كسب الإلكترونات أو المشاركة بها بحيث تصبح محاطة بثمانية من الكترونات التكافؤ ( تصبح مشابهة للتركيب الإلكتروني للغازات النبيلة ) . 6. الإلكترونات الثمانية تعتبر أربعة أزواج من الكترونات التكافؤ وترتب حول رمز العنصر عند كتابة رموز وتراكيب لويس . و. تستخدم تراكيب أو صيغ لويس للتعبير عن المركبات الأيونية مثلاً كلوريد الصوديوم حسب لويس هو :  مثل : مثل : 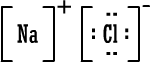 ز.تراكيب لويس للتعبير عن الجزيئات المتشابهة والمركبات ذات الروابط التساهمية . نعرف المركبات ذوات الروابط المشتركة أو التساهمية بسهولة فهي تتكون من لافلزات فقط . نرسم الكترون في الرابطة على شكل نقطتين أو على شكل ( ـ ) .  مثل : جزيء الهيدروجينH2 إما H . . H أو H -H . مثل : جزيء الهيدروجينH2 إما H . . H أو H -H . نرسم الكترونات التكافؤ التي لم تشترك في الربط على شكل نقاط مزدوجة إلا إذا كان عددها فردياً فيوضع أحدها منفرداً في هذه الحالة .  أمثلة : أمثلة : جزيء الماء 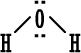 ، جزيء أكسيد النيتريك ح. تراكيب لويس للأيونات عديدة الذرات ( الأيونات المركبةPolyatomicIons) : هي أيونات تتكون من ذرتين أو أكثر مرتبطة ببعضها بروابط تساهيمة بحيث تكون مجموعة مستقرة وتسلك سلوك الأيونات البسيطة عند دخولها في تفاعلات كيميائية ، وهي تحمل شحنة إما موجبة أو سالبة .  أمثلة : +[ NH4 ]،ـ [ OH ] . أمثلة : +[ NH4 ]،ـ [ OH ] .  أمثلةعلى تراكيب لويس للمجموعات : أمثلةعلى تراكيب لويس للمجموعات :مجموعة الأمونيوم 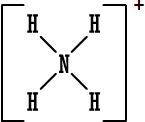 ، مجموعة الهيدروكسيد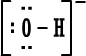 ويمكن للأيونات عديدة الذرات أن ترتبط مع أيونات عناصر مخالفة لها في الشحنة بروابط أيونية مثل NaOHحيث ترتبط مجموعة الهيدروكسيد السالبة مع أيون الصوديوم الموجب أي أن المركب يتكون من أيونين أحدهما بسيط هو+[ Na ] والثاني مركب (عديد الذرات) هو - [ OH ] .  مثال آخر : مثال آخر :NH4Cl كلوريد الأمونيوم وهو يتكون منأيونين أيون بسيط هو  ، وأيون مركب هو ، وأيون مركب هو  ط. لم تعد قاعدة الثمانية القاعدة الوحيدة لاستقرار الذرات ، بل أصبحالاستقرار مرتبطاً بازدواج الإلكترونات وقد يكون عدد الإلكترونات حول الذرة المستقرة من ( 2 ) ( زوج واحد ) إلى ( 14 ) ( سبع أزواج ) . أمثلة : 1.جزيء H2 مستقر بزوج الكتروني واحد ( يشبه ذرة الهيليوم ) . 2.BeCl2 ←  قاعدة الثمانية على البيريليوم . 3. ثلاثة أزواج من الإلكترونات حول ذرة البورون ( وهذا شذود عن قاعدة الثمانية ) ولكن المركب معروف ومستقر تماماً . BF3 قاعدة الثمانية منطبقة بأربعة أزواج من الإلكترونات حول الفلور ← 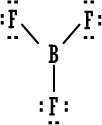 4. مركب خمسة أزواج من الإلكترونات حول ذرة الفوسفور وهذا شذوذ عن قاعدة الثمانية ، أما على الكلور فتنطبق قاعدة الثمانية .PCl5 ← 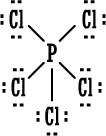 مركب خامس كلوريد الفسفور مشهور وله استخدامات كثيرة في مجالات الكيمياء المختلفة . مركب خامس كلوريد الفسفور مشهور وله استخدامات كثيرة في مجالات الكيمياء المختلفة .5. مجموعة الكبريتات : 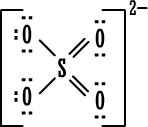 مجموعة الكبريتات مركباتها مشهورة ويكفي أن نذكر منها حمض الكبريتيك . 6. مجموعة فوق الكلورات : 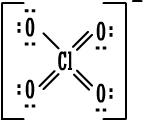 مركبات مجموعة فوق الكلورات مشهورة ، ويستخدم ملح فوق كلورات البوتاسيوم لتحضير الأوكسجين .  التقويم : 1- اكتب رموز لويس لذرات العناصر التالية : أ- الروبيديوم ( Rb) من المجموعة الأولى . ب- الباريوم(Ba) من المجموعة الثانية . ج- الخارصين . د- الجرمانيوم (Ge) من المجموعة الرابعة . هـ- الفضة . و- اليود . 2- اكتب رموز لويس لأيونات العناصر التالية : أ- البوتاسيوم . ب- الكالسيوم . ج- أيون الجاليوم ( Ga ) من المجموعة الثالثة . د- أيوم البروميد Bromide Ion . هـ- أيون الكبريتيد Sulphide Ion . و- أيون الفوسفيدPhosphide Ion [ P ]3- 3- لماذا يصعب على الغازات النبيلة تكوين مركبات أيونية ؟ التقويم : 4- أيهما أسهل على الغازات النبيلة تكوين مركبات بروابط أيونية أم مركبات بروابط مشتركة ، فسّر جوابك. 5- حدّد عدد الكترونات التكافؤ لكل أيون من الأيونات المركبة التالية ، ثم ارسم إحدى صيغ لويس للأيون المعني . * مُلاحظة : يوجد أكثر من صيغة محتملة لكل أيونٍ منها . - أيون أو مجموعة النيترات . [ NO3 ]1- - أيون أو مجموعة الكلورات . [ ClO3 ]1- - أيون أو مجموعة الفوسفات . [ PO4 ]3- - أيون أو مجموعة الكبريتيت(Sulphite). [ SO3 ]2- - مجموعة الكبريتات الهيدروجينية . [ HSO4 ]- 6- حدِّد عدد الكترونات التكافؤ للجزيئات المتعادلة أو المشحونة التالية (الأيونات المركبة) . ثم ارسم تراكيب لويس لكل الجزيئات التي تحوي عدداً فردياً من الكترونات التكافؤ فقط . |
|||

|
|
|
رقم المشاركة : 35 | |||
|
رائعة انت يا مرام |
|||

|
|
|
رقم المشاركة : 36 | |||
|
شكرا طلباتك اوامر |
|||

|
|
|
رقم المشاركة : 37 | |||
|
ربي يوفقك ... |
|||

|
|
|
رقم المشاركة : 38 | |||
|
شششششششششششكككككككككككككككرررررررررررررراااااااااا اااااااا |
|||

|
|
|
رقم المشاركة : 39 | |||
|
رايحة نعطيك طريقة باشتحفظيه اختي مثال تشكليه كلمات لبيبكنوفن li. be.b.c.ne.o.f.n |
|||

|
|
|
رقم المشاركة : 40 | |||
|
شكرا لك أختي والله انها طريقة سهلة للحفظ
|
|||

|
 |
| الكلمات الدلالية (Tags) |
| ممكن, جيجل, يفهمني, سلام, كيمياء |
|
|
المشاركات المنشورة تعبر عن وجهة نظر صاحبها فقط، ولا تُعبّر بأي شكل من الأشكال عن وجهة نظر إدارة المنتدى
المنتدى غير مسؤول عن أي إتفاق تجاري بين الأعضاء... فعلى الجميع تحمّل المسؤولية
Powered by vBulletin .Copyright آ© 2018 vBulletin Solutions, Inc